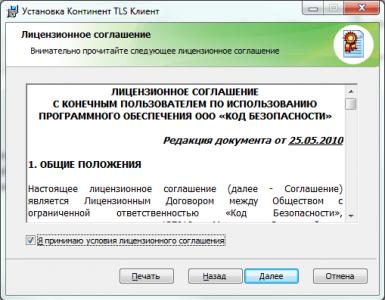
Pohybová rovnica telesa s konštantným zrýchlením. Rýchlosť pri priamočiarom pohybe s konštantným zrýchlením
Ciele lekcie:
Vzdelávacie:
Vzdelávacie:
Vos výživný
Typ lekcie : Kombinovaná hodina.
Zobraziť obsah dokumentu
Téma lekcie: „Zrýchlenie. Priamočiary pohyb s konštantným zrýchlením."
Pripravila Marina Nikolaevna Pogrebnyak, učiteľka fyziky na MBOU “Stredná škola č. 4”
Trieda -11
Lekcia 5/4 Téma lekcie: „Zrýchlenie. Priamočiary pohyb s konštantným zrýchlením».
Ciele lekcie:
Vzdelávacie: Oboznámiť študentov s charakteristické znaky priamočiary rovnomerne zrýchlený pohyb. Uveďte pojem zrýchlenie ako hlavnú fyzikálnu veličinu charakterizujúcu nerovnomerný pohyb. Zadajte vzorec na určenie okamžitej rýchlosti telesa kedykoľvek, vypočítajte okamžitú rýchlosť telesa kedykoľvek,
zlepšiť schopnosť študentov riešiť problémy pomocou analytických a grafických metód.
Vzdelávacie: rozvoj teoretickej výchovy u školákov, kreatívne myslenie, formovanie operatívneho myslenia zameraného na výber optimálnych riešení
Vosvýživný : pestovať uvedomelý postoj k učeniu a záujem o štúdium fyziky.
Typ lekcie : Kombinovaná hodina.
Ukážky:
1. Rovnomerne zrýchlený pohyb gule po naklonenej rovine.
2. Multimediálna aplikácia „Základy kinematiky“: fragment „Rovnomerne zrýchlený pohyb“.
Pokrok.
1.Organizačný moment.
2. Test vedomostí: Samostatná práca(„Posun.“ „Grafy priamočiarych rovnomerný pohyb") - 12 min.
3. Štúdium nového materiálu.
Plán na prezentáciu nového materiálu:
1. Okamžitá rýchlosť.
2. Zrýchlenie.
3. Rýchlosť pri priamočiarom rovnomerne zrýchlenom pohybe.
1. Okamžitá rýchlosť. Ak sa rýchlosť tela mení s časom, na opísanie pohybu potrebujete vedieť, aká je rýchlosť tela tento momentčase (alebo v danom bode trajektórie). Táto rýchlosť sa nazýva okamžitá rýchlosť.
Môžeme tiež povedať, že okamžitá rýchlosť je priemerná rýchlosť za veľmi krátky časový interval. Pri jazde premenlivou rýchlosťou sa priemerná rýchlosť nameraná v rôznych časových intervaloch bude líšiť.
Ak však pri meraní priemernej rýchlosti berieme stále menšie a menšie časové intervaly, bude mať hodnota priemernej rýchlosti tendenciu k nejakej konkrétnej hodnote. Ide o okamžitú rýchlosť v danom časovom okamihu. V budúcnosti, keď hovoríme o rýchlosti telesa, budeme mať na mysli jeho okamžitú rýchlosť.
2. Zrýchlenie. Pri nerovnomernom pohybe je okamžitá rýchlosť telesa premennou veličinou; je rôzna vo veľkosti a (alebo) smere v rôznych časoch a v rôznych bodoch trajektórie. Všetky rýchlomery áut a motocyklov nám ukazujú iba modul okamžitej rýchlosti.
Ak sa okamžitá rýchlosť nerovnomerného pohybu mení nerovnomerne v rovnakých časových úsekoch, potom je veľmi ťažké ju vypočítať.
Takéto zložité nerovnomerné pohyby sa v škole neštudujú. Preto budeme uvažovať len o najjednoduchšom nerovnomernom pohybe – rovnomerne zrýchlenom priamočiarom pohybe.
Priamočiary pohyb, pri ktorom sa okamžitá rýchlosť mení rovnako v ľubovoľných rovnakých časových intervaloch, sa nazýva rovnomerne zrýchlený priamočiary pohyb.
Ak sa rýchlosť telesa počas pohybu mení, vzniká otázka: aká je „miera zmeny rýchlosti“? Táto veličina, nazývaná zrýchlenie, hrá rozhodujúcu úlohu v celej mechanike: čoskoro uvidíme, že zrýchlenie telesa je určené silami pôsobiacimi na toto teleso.
Zrýchlenie je pomer zmeny rýchlosti telesa k časovému intervalu, počas ktorého k tejto zmene došlo.
Jednotkou zrýchlenia v SI je m/s2.
Ak sa teleso pohybuje v jednom smere so zrýchlením 1 m/s 2 , jeho rýchlosť sa každú sekundu mení o 1 m/s.
Pojem „zrýchlenie“ sa vo fyzike používa, keď sa hovorí o akejkoľvek zmene rýchlosti, vrátane prípadov, keď sa modul rýchlosti zníži alebo keď modul rýchlosti zostane nezmenený a rýchlosť sa zmení iba v smere.
3. Rýchlosť pri priamočiarom rovnomerne zrýchlenom pohybe.
Z definície zrýchlenia vyplýva, že v = v 0 + at.
Ak nasmerujeme os x pozdĺž priamky, po ktorej sa teleso pohybuje, potom v projekciách na os x dostaneme v x = v 0 x + a x t.
Pri priamočiarom rovnomerne zrýchlenom pohybe teda projekcia rýchlosti závisí lineárne od času. To znamená, že graf v x (t) je priamka.
Vzorec pohybu:
Graf rýchlosti zrýchľujúceho auta:

Graf rýchlosti brzdiaceho auta

4. Konsolidácia nového materiálu.
Aká je okamžitá rýchlosť kameňa hodeného zvisle nahor v hornom bode jeho trajektórie?
O akej rýchlosti - priemernej alebo okamžitej - hovoríme v nasledujúcich prípadoch:
a) vlak išiel medzi stanicami rýchlosťou 70 km/h;
b) rýchlosť pohybu kladiva pri náraze je 5 m/s;
c) rýchlomer na elektrickom rušni ukazuje 60 km/h;
d) guľka opúšťa pušku rýchlosťou 600 m/s.
ÚLOHY RIEŠENÉ NA HODINE
Os OX smeruje pozdĺž trajektórie priamočiareho pohybu tela. Čo môžete povedať o pohybe, v ktorom: a) v x 0, a x 0; b) v x 0, a x v x x 0;
d) v x x v x x = 0?
1. Hokejista ľahko trafil puk hokejkou, pričom mu udelil rýchlosť 2 m/s. Aká bude rýchlosť puku 4 s po náraze, ak sa v dôsledku trenia o ľad bude pohybovať so zrýchlením 0,25 m/s 2?
2. Vlak 10 s po začatí pohybu nadobudne rýchlosť 0,6 m/s. Ako dlho po začatí pohybu dosiahne rýchlosť vlaku 3 m/s?
5. DOMÁCE ÚLOHY: §5,6, napr. 5 č. 2, býv. 6 č. 2.
Od DA
12.12.2018 17:31"; $(html).insertAfter(this); (adsbygoogle = window.adsbygoogle || ).push(); ) i++; )) ) ) )) funkcia images_share(elm)( var url = $(elm) .find (.fb-like").data("href"); var title = $(elm).find(".post_content_text").children("h2").text(); var desc = $( elm) .find(".short_description_of_post").text(); $(elm).find(".post_in_image").each(function())( $(this).wrap(function())( return "
"+$(this).text()+"
"; )); )) $(brest).find(".post_image").each(function())( $(this).append("
"); $(this).hover(function() ( $(this).find(".soc_image").animate(("margin-right":"1%"),200); ), function() ( $(this).find(".soc_image").animate(("margin-right":"-192px"),200); )) )) funkcia ads_comed(elm)( var html = ""; var k =0; $(elm).find(".post_in_image").each(function())( if(k%3==0)( $(html).insertAfter(this); (adsbygoogle = window.adsbygoogle | | ).push(()); ) k++; )) )
Obsah tejto stránky, ako sú články, text, grafika, obrázky a iné materiály uverejnené na tejto stránke („Obsah“), slúži len na informačné účely. V súvislosti s Obsahom poskytovaným na tejto stránke sa neposkytujú žiadne vyhlásenia ani záruky akéhokoľvek druhu, výslovné alebo implicitné, pokiaľ ide o jeho úplnosť, presnosť, spoľahlivosť, vhodnosť alebo dostupnosť na akýkoľvek účel. Akékoľvek použitie obsahu je na vaše vlastné riziko. Obsah by sa nemal chápať ako profesionálne právne, lekárske, finančné, rodinné poradenstvo, riadenie rizík alebo akékoľvek iné odborné poradenstvo. Ak nejaké potrebujete konkrétne rady, poraďte sa s licencovaným odborníkom alebo odborníkom v príslušnej oblasti. Vydavateľ nezodpovedá za žiadne zranenie alebo poškodenie čitateľa, ktoré môže vyplynúť z toho, že čitateľ bude konať alebo používať Obsah obsiahnutý na tejto Stránke.
. Úplné alebo čiastočné kopírovanie materiálov stránok bez súhlasu redakcie je zakázané.
Pohyb. Teplo Kitaygorodsky Alexander Isaakovich
Priamočiary pohyb s konštantným zrýchlením
K takémuto pohybu dochádza podľa Newtonovho zákona, keď na telo pôsobí konštantná sila, ktorá telo tlačí alebo brzdí.
Aj keď to nie je úplne presné, takéto stavy vznikajú pomerne často: auto bežiace s vypnutým motorom je brzdené pôsobením približne konštantnej trecej sily, ťažký predmet padá z výšky pod vplyvom konštantnej gravitácie.
Keď poznáme veľkosť výslednej sily, ako aj hmotnosť telesa, zistíme podľa vzorca a = F/m hodnota zrýchlenia. Pretože
Kde t- čas pohybu, v– konečná a v 0 je počiatočná rýchlosť, potom pomocou tohto vzorca môžete odpovedať na niekoľko otázok nasledujúceho charakteru: ako dlho bude trvať zastavenie vlaku, ak sú známe brzdné sily, hmotnosť vlaku a počiatočná rýchlosť? Na akú rýchlosť bude auto zrýchľovať, ak je známy výkon motora, sila odporu, hmotnosť auta a čas zrýchlenia?
Často nás zaujíma dĺžka dráhy, ktorú prejde teleso v rovnomerne zrýchlenom pohybe. Ak je pohyb rovnomerný, prejdená vzdialenosť sa zistí vynásobením rýchlosti pohybu časom pohybu. Ak je pohyb rovnomerne zrýchlený, potom sa prejdená vzdialenosť vypočíta tak, ako keby sa telo pohybovalo súčasne t rovnomerne pri rýchlosti rovnajúcej sa polovici súčtu počiatočnej a konečnej rýchlosti:

Takže pri rovnomerne zrýchlenom (alebo pomalom) pohybe sa dráha, ktorú telo prejde, rovná súčinu polovice súčtu počiatočnej a konečnej rýchlosti a času pohybu. Rovnakú vzdialenosť prejde za rovnaký čas rovnomerným pohybom rýchlosťou (1/2)( v 0 + v). V tomto zmysle asi (1/2)( v 0 + v) môžeme povedať, že ide o priemernú rýchlosť rovnomerne zrýchleného pohybu.
Je užitočné vytvoriť vzorec, ktorý by ukázal závislosť prejdenej vzdialenosti od zrýchlenia. Nahrádzanie v = v 0 + pri v poslednom vzorci nájdeme:

alebo ak k pohybu dôjde bez počiatočnej rýchlosti,
Ak teleso prejde 5 m za jednu sekundu, potom za dve sekundy prejde (4?5) m, za tri sekundy - (9?5) m atď. Prejdená vzdialenosť sa zvyšuje úmerne so štvorcom času.
Podľa tohto zákona padá ťažké telo z výšky. Zrýchlenie pri voľnom páde je g a vzorec má nasledujúci tvar:

Ak t nahradiť v priebehu niekoľkých sekúnd.
Ak by telo dokázalo bez rušenia padať len 100 sekúnd, prešlo by od začiatku pádu obrovskú vzdialenosť – asi 50 km. V tomto prípade sa za prvých 10 sekúnd prejde iba (1/2) km - to znamená zrýchlený pohyb.
Akú rýchlosť však vyvinie teleso pri páde z danej výšky? Na zodpovedanie tejto otázky budeme potrebovať vzorce týkajúce sa prejdenej vzdialenosti so zrýchlením a rýchlosťou. Nahrádzanie v S = (1/2)(v 0 + v)t hodnota času pohybu t = (v ? v 0)/a, dostaneme:

alebo ak je počiatočná rýchlosť nula,

Desať metrov je výška malého dvoj- alebo trojposchodového domu. Prečo je nebezpečné skočiť na Zem zo strechy takéhoto domu? Jednoduchý výpočet ukazuje, že rýchlosť voľného pádu dosiahne hodnotu v= sqrt(2·9,8·10) m/s = 14 m/s? 50 km/h, ale to je rýchlosť mestského auta.
Odpor vzduchu túto rýchlosť veľmi nezníži.
Vzorce, ktoré sme odvodili, sa používajú na širokú škálu výpočtov. Využime ich, aby sme videli, ako dochádza k pohybu na Mesiaci.
Wellsov román Prví muži na Mesiaci rozpráva o prekvapeniach, ktoré zažili cestovatelia na svojich fantastických výletoch. Na Mesiaci je gravitačné zrýchlenie asi 6-krát menšie ako na Zemi. Ak na Zemi prejde padajúce teleso za prvú sekundu 5 m, potom na Mesiaci „spláva“ len 80 cm (zrýchlenie je približne 1,6 m/s2).
Skok z výšky hčas trvá t= sqrt(2 h/g). Keďže mesačné zrýchlenie je 6-krát menšie ako zemské, potom na Mesiaci budete potrebovať sqrt(6) ? 2,45-krát dlhšie. Koľkokrát sa konečná rýchlosť skoku zníži ( v= sqrt(2 gh))?
Na Mesiaci môžete bezpečne skočiť zo strechy trojposchodovej budovy. Výška skoku s rovnakou počiatočnou rýchlosťou sa zväčší šesťkrát (vzorec h = v 2 /(2g)). Dieťa bude schopné urobiť skok, ktorý presahuje pozemský rekord.
Z knihy Fyzika: Paradoxná mechanika v otázkach a odpovediach autora Gulia Nurbey Vladimirovič4. Pohyb a sila
Z knihy Najnovšia kniha faktov. Zväzok 3 [Fyzika, chémia a technika. História a archeológia. Zmiešaný] autora Kondrashov Anatolij Pavlovič Z knihy Teória vesmíru od Eternusa Z knihy Zaujímavosti o astronómii autora Tomilin Anatolij Nikolajevič9. Pohyb Mesiaca Mesiac obieha okolo Zeme s periódou 27 dní 7 hodín 43 minút a 11,5 sekundy. Toto obdobie sa nazýva hviezdny mesiac. Mesiac sa otáča okolo vlastnej osi s presne rovnakou periódou. Preto je jasné, že nás neustále oslovujú
Z knihy Evolúcia fyziky autora Einstein AlbertÉter a pohyb Galileov princíp relativity platí pre mechanické javy. Vo všetkých inerciálnych sústavách, ktoré sa navzájom pohybujú, platia rovnaké zákony mechaniky. Platí táto zásada aj pre nemechanické javy, najmä tie pre
Z knihy Fyzika na každom kroku autora Perelman Jakov IsidorovičPohyb v kruhu Otvorte dáždnik, položte jeho koniec na podlahu, roztočte ho a vhoďte dovnútra guľu, pokrčený papier, vreckovku - vo všeobecnosti čokoľvek ľahké a nerozbitné. Stane sa vám niečo nečakané. Zdá sa, že dáždnik nechce prijať dar: loptu alebo papierovú guľu
Z knihy Pohyb. Teplo autora Kitaygorodsky Alexander IsaakovičPohyb je relatívny Zákon zotrvačnosti nás vedie k záveru o mnohosti inerciálnych sústav. Nie jeden, ale mnohé referenčné systémy vylučujú „bezpríčinné“ pohyby. Ak sa nájde jeden taký systém, okamžite sa nájde ďalší, ktorý sa bude pohybovať translačne ( bez
Z knihy Systémy sveta (od staroveku po Newtona) autora Gurev Grigorij AbramovičPohyb po kružnici Ak sa bod pohybuje po kružnici, potom sa pohyb zrýchľuje, už len preto, že rýchlosť v každom okamihu mení svoj smer. Rýchlosť môže zostať nezmenená a na to sa zameriame
Z knihy 1. Moderná veda o prírode, zákonoch mechaniky autora Feynman Richard PhillipsPrúdový pohyb Osoba sa pohybuje tlačením od zeme; čln pláva, pretože veslári odtláčajú vodu veslami; Motorová loď sa tiež tlačí od vody, len nie veslami, ale vrtuľami. Vlak jazdiaci po koľajniciach a auto sa tiež odrážajú od zeme -
Z knihy Faraday. Elektromagnetická indukcia [Veda vysokého napätia] autora Castillo Sergio RarraVI. Pohyb tuhých telies Moment sily Skúste rukou roztočiť ťažký zotrvačník. Potiahnite lúč. Bude to pre vás ťažké, ak si chytíte ruku príliš blízko osi. Posuňte ruku k okraju a všetko pôjde ľahšie. Čo sa zmenilo? Predsa sila v oboch prípadoch
Z knihy autoraAko vyzerá tepelný pohyb Interakcie medzi molekulami môžu byť v „živote“ molekúl viac či menej dôležité. Tri stavy hmoty – plynné, kvapalné a pevné – sa navzájom líšia úlohou, ktorú v nich zohráva interakcia.
Z knihy autoraPREMENA ELEKTRINY NA POHYB Faraday si všimol jeden malý detail v Oerstedových experimentoch, ktorý, ako sa zdá, obsahoval kľúč k pochopeniu problému: uhádol, že magnetizmus elektrického prúdu vždy vychýli strelku kompasu jedným smerom. Napríklad ak
Pre rovnomerne zrýchlený pohyb platia nasledujúce rovnice, ktoré uvádzame bez odvodenia:
Ako viete, vektorový vzorec vľavo a dva skalárne vzorce vpravo sú rovnaké. Z hľadiska algebry skalárne vzorce znamenajú, že pri rovnomerne zrýchlenom pohybe projekcie posunutia závisia od času podľa kvadratického zákona. Porovnajte to s charakterom projekcií okamžitej rýchlosti (pozri § 12-h).
Keď vieme, že sx = x – xo a sy = y – yo (pozri § 12), z dvoch skalárnych vzorcov z pravého horného stĺpca získame rovnice pre súradnice:
Keďže zrýchlenie pri rovnomerne zrýchlenom pohybe telesa je konštantné, súradnicové osi možno vždy umiestniť tak, aby vektor zrýchlenia smeroval rovnobežne s jednou osou, napríklad s osou Y. Pohybová rovnica pozdĺž osi X bude teda výrazne zjednodušené:
x = xo + υox t + (0) a y = yo + υoy t + ½ ay t²
Upozorňujeme, že ľavá rovnica sa zhoduje s rovnicou rovnomerného priamočiareho pohybu (pozri § 12-g). To znamená, že rovnomerne zrýchlený pohyb sa môže „skladať“ z rovnomerného pohybu pozdĺž jednej osi a rovnomerne zrýchleného pohybu pozdĺž druhej osi. Potvrdzujú to skúsenosti s jadrom na jachte (pozri § 12-b).
Úloha. Dievča natiahlo ruky a hodilo loptu. Vzrástol o 80 cm a čoskoro padol k nohám dievčaťa a preletel 180 cm. Akou rýchlosťou bola lopta hodená a akú rýchlosť mala, keď dopadla na zem?
Odmocnime obe strany rovnice na priemet okamžitej rýchlosti na os Y: υy = υoy + ay t (pozri § 12). Dostaneme rovnosť:
υy² = ( υoy + ay t )² = υoy² + 2 υoy ay t + ay² t²
Vyberme zo zátvoriek faktor 2 ay iba pre dva výrazy na pravej strane:
υy² = υoy² + 2 ay ( υoy t + ½ ay t² )
Všimnite si, že v zátvorkách dostaneme vzorec na výpočet priemetu posunutia: sy = υoy t + ½ ay t². Nahradením sy dostaneme:
Riešenie. Urobme kresbu: nasmerujte os Y nahor a umiestnite začiatok súradníc na zem k nohám dievčaťa. Použime vzorec, ktorý sme odvodili pre druhú mocninu projekcie rýchlosti, najprv v hornom bode stúpania lopty:

0 = υoy² + 2·(–g)·(+h) ⇒ υoy = ±√¯2gh = +4 m/s
Potom, keď sa začnete pohybovať z horného bodu nadol:
υy² = 0 + 2·(–g)·(–H) ⇒ υy = ±√¯2gh = –6 m/s
Odpoveď: loptička bola hodená smerom nahor rýchlosťou 4 m/s a v momente dopadu mala rýchlosť 6 m/s, nasmerovaná proti osi Y.
Poznámka. Dúfame, že chápete, že vzorec pre štvorcovú projekciu okamžitej rýchlosti bude správny analogicky pre os X:
Ak je pohyb jednorozmerný, to znamená, že sa vyskytuje iba pozdĺž jednej osi, môžete použiť ktorýkoľvek z dvoch vzorcov v rámci.
Priamočiary pohyb s konštantným zrýchlením sa nazýva rovnomerne zrýchlený, ak sa modul rýchlosti s časom zvyšuje, alebo rovnomerne spomalený, ak sa zmenšuje.
Príkladom zrýchleného pohybu môže byť kvetináč padajúci z balkóna nízkej budovy. Na začiatku jesene je rýchlosť hrnca nulová, no za pár sekúnd sa stihne zvýšiť na desiatky m/s. Príkladom spomaleného pohybu je pohyb kameňa hodeného kolmo nahor, ktorého rýchlosť je spočiatku vysoká, ale potom postupne klesá až na nulu v hornom bode trajektórie. Ak zanedbáme silu odporu vzduchu, tak zrýchlenie v oboch týchto prípadoch bude rovnaké a rovné zrýchleniu voľného pádu, ktoré smeruje vždy kolmo nadol, značí sa písmenom g a rovná sa približne 9,8 m/s2. .
Gravitačné zrýchlenie g je spôsobené gravitačnou silou Zeme. Táto sila urýchľuje všetky telesá pohybujúce sa smerom k Zemi a spomaľuje tie, ktoré sa od nej vzďaľujú.
kde v je rýchlosť telesa v čase t, odkiaľ po jednoduchých transformáciách získame rovnica pre rýchlosť pri pohybe s konštantným zrýchlením: v = v0 + pri
8. Pohybové rovnice s konštantným zrýchlením.
Aby sme našli rovnicu pre rýchlosť počas lineárneho pohybu s konštantným zrýchlením, budeme predpokladať, že v čase t=0 malo teleso počiatočnú rýchlosť v0. Keďže zrýchlenie a je konštantné, pre každý čas t platí nasledujúca rovnica:
kde v je rýchlosť telesa v čase t, odkiaľ po jednoduchých transformáciách získame rovnicu pre rýchlosť pri pohybe s konštantným zrýchlením: v = v0 + pri
Aby sme odvodili rovnicu pre dráhu prejdenú počas priamočiareho pohybu s konštantným zrýchlením, najprv zostrojíme graf závislosti rýchlosti od času (5.1). Pre a>0 je graf tejto závislosti znázornený vľavo na obr. 5 (modrá priamka). Ako sme uviedli v § 3, pohyb uskutočnený počas času t možno určiť výpočtom plochy pod krivkou závislosti rýchlosti od času medzi momentmi t=0 a t. V našom prípade je obrázok pod krivkou ohraničený dvoma zvislými čiarami t = 0 a t lichobežníkovým OABC, ktorého plocha, ako je známe, sa rovná súčinu polovice súčtu dĺžok. základne OA a CB a výška OC:
Ako je možné vidieť na obr. 5, OA = v0, CB = v0 + at a OC = t. Dosadením týchto hodnôt do (5.2) získame nasledujúcu rovnicu pre posun S uskutočnený v čase t počas priamočiareho pohybu s konštantným zrýchlením a pri počiatočnej rýchlosti v0:
Je ľahké ukázať, že vzorec (5.3) platí nielen pre pohyb so zrýchlením a>0, pre ktorý bol odvodený, ale aj v prípadoch, keď a<0. На рис.5 справа красными линиями показаны графики зависимости S при положительных (верх) и отрицательных (низ) значениях a, построенные по формуле (5.3) для различных величин v0. Видно, что в отличие от равномерного движения (см. рис. 3), график зависимости перемещения от времени является параболой, а не прямой, показанной для сравнения пунктирной линией.
9. Voľný pád tiel. Pohyb s konštantným zrýchlením v dôsledku gravitácie.
Voľný pád telies je pád telies na Zem bez odporu vzduchu (vo vákuu)
Zrýchlenie, s ktorým telesá padajú na Zem, sa nazýva gravitačné zrýchlenie. Vektor zrýchlenia voľného pádu je označený symbolom, je nasmerovaný zvisle nadol. Na rôznych miestach zemegule, v závislosti od zemepisnej šírky a nadmorskej výšky, nie je číselná hodnota g rovnaká, pohybuje sa od približne 9,83 m/s2 na póloch do 9,78 m/s2 na rovníku. V zemepisnej šírke Moskvy g = 9,81523 m/s2. Zvyčajne, ak sa pri výpočtoch nevyžaduje vysoká presnosť, potom sa číselná hodnota g na povrchu Zeme rovná 9,8 m/s2 alebo dokonca 10 m/s2.
Jednoduchým príkladom voľného pádu je teleso padajúce z určitej výšky h bez počiatočnej rýchlosti. Voľný pád je lineárny pohyb s konštantným zrýchlením.
Ideálny voľný pád je možný len vo vákuu, kde nie je odpor vzduchu a bez ohľadu na hmotnosť, hustotu a tvar padajú všetky telesá rovnako rýchlo, t.j. v každom okamihu majú telesá rovnakú okamžitú rýchlosť a zrýchlenie.
Všetky vzorce pre rovnomerne zrýchlený pohyb sú použiteľné pre voľne padajúce telesá.
Veľkosť rýchlosti pri voľnom páde telesa v ľubovoľnom čase:
pohyb tela:
V tomto prípade sa namiesto zrýchlenia a do vzorcov pre rovnomerne zrýchlený pohyb zavedie tiažové zrýchlenie g = 9,8 m/s2.
10. Pohyb telies. VPRED POHYB TUHÉHO TELA
Translačný pohyb tuhého telesa je taký pohyb, pri ktorom sa každá priamka, vždy spojená s telesom, pohybuje rovnobežne sama so sebou. Na to stačí, aby sa dve nerovnobežné čiary spojené s telom pohybovali rovnobežne so sebou. Počas translačného pohybu všetky body telesa opisujú identické, paralelné trajektórie a majú rovnaké rýchlosti a zrýchlenia v danom čase. Translačný pohyb telesa je teda určený pohybom jedného z jeho bodov O.
Vo všeobecnom prípade sa translačný pohyb vyskytuje v trojrozmernom priestore, ale jeho hlavná vlastnosť - zachovanie rovnobežnosti akéhokoľvek segmentu so sebou - zostáva v platnosti.
Napríklad kabína výťahu sa pohybuje dopredu. Podľa prvého priblíženia kabína ruského kolesa vykonáva translačný pohyb. Prísne vzaté však pohyb kabíny ruského kolesa nemožno považovať za progresívny. Ak sa teleso pohybuje translačne, potom na opísanie jeho pohybu stačí opísať pohyb ľubovoľného bodu (napríklad pohyb ťažiska telesa).
Ak telesá, ktoré tvoria uzavretý mechanický systém, interagujú medzi sebou iba prostredníctvom gravitačných a elastických síl, potom sa práca týchto síl rovná zmene potenciálnej energie telies s opačným znamienkom: A = – (E р2 – E р1).
Podľa vety o kinetickej energii sa táto práca rovná zmene kinetickej energie telies
Preto
Alebo Ek1 + Ep1 = Ek2 + Ep2.
Súčet kinetickej a potenciálnej energie telies, ktoré tvoria uzavretý systém a vzájomne na seba pôsobia prostredníctvom gravitačných a elastických síl, zostáva nezmenený.
Toto tvrdenie vyjadruje zákon zachovania energie v mechanických procesoch. Je to dôsledok Newtonových zákonov. Súčet E = E k + E p sa nazýva celková mechanická energia. Zákon zachovania mechanickej energie je splnený iba vtedy, keď telesá v uzavretom systéme na seba vzájomne pôsobia konzervatívnymi silami, teda silami, pre ktoré možno zaviesť pojem potenciálna energia.
Mechanická energia uzavretého systému telies sa nemení, ak medzi týmito telesami pôsobia iba konzervatívne sily. Konzervatívne sily sú tie sily, ktorých pôsobenie pozdĺž akejkoľvek uzavretej trajektórie sa rovná nule. Gravitácia patrí medzi konzervatívne sily.
V reálnych podmienkach na pohybujúce sa telesá takmer vždy pôsobia spolu s gravitačnými silami, elastickými silami a inými konzervatívnymi silami aj trecie sily alebo sily odporu prostredia.
Trecia sila nie je konzervatívna. Práca vykonaná trecou silou závisí od dĺžky dráhy.
Ak medzi telesami, ktoré tvoria uzavretý systém, pôsobia trecie sily, mechanická energia sa nešetrí. Časť mechanickej energie sa premieňa na vnútornú energiu telies (ohrievanie).
Počas akýchkoľvek fyzických interakcií sa energia neobjavuje ani nezmizne. Len sa mení z jednej formy do druhej.
Jedným z dôsledkov zákona zachovania a premeny energie je konštatovanie o nemožnosti vytvorenia „perpetum mobile“ (perpetuum mobile) – stroja, ktorý by mohol pracovať donekonečna bez spotreby energie.
História uchováva značný počet projektov „perpetum mobile“. V niektorých z nich sú chyby „vynálezcu“ zrejmé, v iných sú tieto chyby maskované zložitým dizajnom zariadenia a môže byť veľmi ťažké pochopiť, prečo tento stroj nebude fungovať. Bezvýsledné pokusy o vytvorenie „večného stroja“ pokračujú aj v našej dobe. Všetky tieto pokusy sú odsúdené na neúspech, pretože zákon zachovania a transformácie energie „zakazuje“ získať prácu bez vynaloženia energie.
31. Základné princípy molekulárnej kinetickej teórie a ich opodstatnenie.
Všetky telá sa skladajú z molekúl, atómov a elementárnych častíc, ktoré sú oddelené medzerami, pohybujú sa náhodne a navzájom sa ovplyvňujú.
Kinematika a dynamika nám pomáhajú opísať pohyb telesa a určiť silu, ktorá tento pohyb spôsobuje. Mechanik však nevie odpovedať na veľa otázok. Z čoho sú napríklad vyrobené telá? Prečo sa mnohé látky pri zahrievaní stávajú tekutými a potom sa vyparujú? A vo všeobecnosti, čo je teplota a teplo?
Na podobné otázky sa už pred 25 storočiami pokúšal odpovedať staroveký grécky filozof Demokritos. Bez toho, aby vykonal akékoľvek experimenty, dospel k záveru, že telesá sa nám len zdajú pevné, no v skutočnosti pozostávajú z drobných čiastočiek oddelených prázdnotou. Vzhľadom na to, že tieto častice nebolo možné rozdrviť, Demokritos ich nazval atómy, čo v preklade z gréčtiny znamená nedeliteľné. Tiež navrhol, že atómy môžu byť rôzne a sú v neustálom pohybe, ale my to nevidíme, pretože sú veľmi malé.
M.V. významne prispel k rozvoju molekulárnej kinetickej teórie. Lomonosov. Lomonosov ako prvý naznačil, že teplo odráža pohyb atómov v tele. Okrem toho zaviedol pojem jednoduchých a zložitých látok, ktorých molekuly pozostávajú z rovnakých a rôznych atómov, resp.
Molekulárna fyzika alebo molekulárna kinetická teória je založená na určitých predstavách o štruktúre hmoty
Podľa atómovej teórie štruktúry hmoty je teda najmenšia častica látky, ktorá si zachováva všetky svoje chemické vlastnosti, molekula. Dokonca aj veľké molekuly pozostávajúce z tisícok atómov sú také malé, že ich nemožno vidieť svetelným mikroskopom. Početné experimenty a teoretické výpočty ukazujú, že veľkosť atómov je asi 10 -10 m Veľkosť molekuly závisí od toho, z koľkých atómov pozostáva a ako sú navzájom umiestnené.
Molekulárna kinetická teória je štúdium štruktúry a vlastností hmoty založené na myšlienke existencie atómov a molekúl ako najmenších častíc chemických látok.
Molekulárna kinetická teória je založená na troch hlavných princípoch:
1. Všetky látky – kvapalné, tuhé aj plynné – sú tvorené z najmenších častíc – molekúl, ktoré samy o sebe pozostávajú z atómov („elementárnych molekúl“). Molekuly chemickej látky môžu byť jednoduché alebo zložité, t.j. pozostávajú z jedného alebo viacerých atómov. Molekuly a atómy sú elektricky neutrálne častice. Za určitých podmienok môžu molekuly a atómy získať dodatočný elektrický náboj a stať sa kladnými alebo zápornými iónmi.
2. Atómy a molekuly sú v nepretržitom chaotickom pohybe.
3. Častice medzi sebou interagujú silami, ktoré majú elektrický charakter. Gravitačná interakcia medzi časticami je zanedbateľná.
Najvýraznejším experimentálnym potvrdením myšlienok molekulárnej kinetickej teórie o náhodnom pohybe atómov a molekúl je Brownov pohyb. Ide o tepelný pohyb drobných mikroskopických častíc suspendovaných v kvapaline alebo plyne. Objavil ho anglický botanik R. Brown v roku 1827. Brownove častice sa pohybujú pod vplyvom náhodných dopadov molekúl. Kvôli chaotickému tepelnému pohybu molekúl sa tieto dopady nikdy navzájom nevyrovnajú. V dôsledku toho sa rýchlosť Brownovej častice náhodne mení vo veľkosti a smere a jej trajektória je zložitá kľukatá krivka.
Neustály chaotický pohyb molekúl látky sa prejavuje aj ďalším ľahko pozorovateľným javom – difúziou. Difúzia je fenomén prenikania dvoch alebo viacerých kontaktujúcich látok do seba. Proces prebieha najrýchlejšie v plyne.
Náhodný chaotický pohyb molekúl sa nazýva tepelný pohyb. Kinetická energia tepelného pohybu sa zvyšuje so zvyšujúcou sa teplotou.
Mol je množstvo látky obsahujúce rovnaký počet častíc (molekúl), koľko je atómov v 0,012 kg uhlíka 12 C. Molekula uhlíka pozostáva z jedného atómu.
32. Hmotnosť molekúl, relatívna molekulová hmotnosť molekúl. 33. Molová hmotnosť molekúl. 34. Množstvo látky. 35. Avogadrova konštanta.
V molekulárnej kinetickej teórii sa množstvo hmoty považuje za úmerné počtu častíc. Jednotka množstva látky sa nazýva mol (mol).
Mol je množstvo látky obsahujúce rovnaký počet častíc (molekúl), koľko je atómov v 0,012 kg (12 g) uhlíka 12 C. Molekula uhlíka pozostáva z jedného atómu.
Jeden mol látky obsahuje počet molekúl alebo atómov rovný Avogadrovej konštante.
Jeden mol akejkoľvek látky teda obsahuje rovnaký počet častíc (molekúl). Toto číslo sa nazýva Avogadrova konštanta N A: N A = 6,02·10 23 mol –1.
Avogadrova konštanta je jednou z najdôležitejších konštánt v teórii molekulárnej kinetiky.
Látkové množstvo ν je definované ako pomer počtu N častíc (molekúl) látky k Avogadrovej konštante N A:
Molová hmotnosť M je pomer hmotnosti m danej vzorky látky k množstvu n látky v nej obsiahnutej:
ktorá sa číselne rovná hmotnosti látky odobratej v množstve jedného mólu. Molová hmotnosť v sústave SI je vyjadrená v kg/mol.
Relatívna molekulová alebo atómová hmotnosť látky je teda pomer hmotnosti jej molekuly a atómu k 1/12 hmotnosti atómu uhlíka.
36. Brownov pohyb.
Mnohé prírodné javy naznačujú chaotický pohyb mikročastíc, molekúl a atómov hmoty. Čím vyššia je teplota látky, tým je tento pohyb intenzívnejší. Preto je teplo telesa odrazom náhodného pohybu molekúl a atómov, ktoré ho tvoria.
Dôkazom toho, že všetky atómy a molekuly látky sú v neustálom a náhodnom pohybe, môže byť difúzia – vzájomné prenikanie častíc jednej látky do druhej.
Vôňa sa tak rýchlo šíri po miestnosti aj pri absencii pohybu vzduchu. Kvapka atramentu rýchlo sfarbí celý pohár vody do rovnomernej čiernej farby.
Difúziu možno zistiť aj v pevných látkach, ak sú pevne stlačené a ponechané dlhší čas. Fenomén difúzie ukazuje, že mikročastice látky sú schopné spontánneho pohybu vo všetkých smeroch. Tento pohyb mikročastíc látky, ako aj jej molekúl a atómov, sa nazýva tepelný pohyb.
BROWNOV POHYB - náhodný pohyb drobných častíc suspendovaných v kvapaline alebo plyne, ku ktorému dochádza pod vplyvom vplyvov molekúl prostredia; objavil R. Brown v roku 1827
Pozorovania ukazujú, že Brownov pohyb sa nikdy nezastaví. V kvapke vody (ak ju nenecháte vyschnúť) je možné sledovať pohyb zŕn mnoho dní, mesiacov, rokov. Nezastaví sa ani v lete, ani v zime, ani vo dne, ani v noci.
Dôvod Brownovho pohybu spočíva v nepretržitom, nikdy nekončiacom pohybe molekúl kvapaliny, v ktorej sa nachádzajú zrná pevnej látky. Samozrejme, tieto zrná sú mnohonásobne väčšie ako samotné molekuly a keď vidíme pohyb zŕn pod mikroskopom, nemali by sme si myslieť, že vidíme pohyb samotných molekúl. Molekuly nie je možné vidieť bežným mikroskopom, ale ich existenciu a pohyb môžeme posúdiť podľa nárazov, ktoré vytvárajú, pričom tlačia zrnká pevného telesa a spôsobujú ich pohyb.
Objav Brownovho pohybu mal veľký význam pre štúdium štruktúry hmoty. Ukázalo sa, že telesá sa naozaj skladajú z jednotlivých častíc – molekúl a že molekuly sú v nepretržitom náhodnom pohybe.
Vysvetlenie Brownovho pohybu bolo podané až v poslednej štvrtine 19. storočia, keď mnohým vedcom začalo byť jasné, že pohyb Brownovej častice je spôsobený náhodnými dopadmi molekúl média (kvapaliny alebo plynu), ktoré prechádzajú tepelným pohybom. V priemere molekuly média narážajú na Brownovu časticu zo všetkých smerov rovnakou silou, avšak tieto dopady sa nikdy navzájom presne nezrušia a v dôsledku toho sa rýchlosť Brownovej častice náhodne mení vo veľkosti a smere. Preto sa Brownova častica pohybuje po kľukatej dráhe. Navyše, čím menšia je veľkosť a hmotnosť Brownovej častice, tým je jej pohyb zreteľnejší.
Analýza Brownovho pohybu tak položila základy modernej molekulárnej kinetickej teórie štruktúry hmoty.
37. Sily interakcie medzi molekulami. 38. Štruktúra plynných látok. 39. Štruktúra kvapalných látok. 40. Štruktúra pevných látok.
Vzdialenosť medzi molekulami a sily pôsobiace medzi nimi určujú vlastnosti plynných, kvapalných a pevných telies.
Sme zvyknutí na to, že kvapalina sa môže prelievať z jednej nádoby do druhej a plyn rýchlo vyplní celý objem, ktorý je jej k dispozícii. Voda môže prúdiť len korytom a vzduch nad ňou nepozná hraníc.
Medzi všetkými molekulami existujú medzimolekulové príťažlivé sily, ktorých veľkosť veľmi rýchlo klesá, keď sa molekuly od seba vzďaľujú, a preto na vzdialenosť rovnajúcu sa niekoľkým priemerom molekúl vôbec neinteragujú.
Medzi molekulami kvapaliny umiestnenými takmer blízko seba teda pôsobia príťažlivé sily, ktoré bránia týmto molekulám rozptyľovať sa v rôznych smeroch. Naopak, nepatrné príťažlivé sily medzi molekulami plynu ich nedokážu udržať pohromade, a preto sa plyny môžu rozpínať a naplniť celý objem, ktorý im je poskytnutý. Existenciu medzimolekulových príťažlivých síl možno overiť vykonaním jednoduchého experimentu – stlačením dvoch olovených tyčí proti sebe. Ak sú kontaktné plochy dostatočne hladké, tyče sa zlepia a bude ťažké ich oddeliť.
Samotné medzimolekulové príťažlivé sily však nedokážu vysvetliť všetky rozdiely medzi vlastnosťami plynných, kvapalných a pevných látok. Prečo je napríklad veľmi ťažké zmenšiť objem kvapaliny alebo pevnej látky, ale stlačiť balón je pomerne jednoduché? Vysvetľuje sa to tým, že medzi molekulami sú nielen príťažlivé sily, ale aj medzimolekulové odpudivé sily, ktoré pôsobia, keď sa elektrónové obaly atómov susedných molekúl začnú prekrývať. Práve tieto odpudivé sily bránia jednej molekule preniknúť do objemu, ktorý už zaberá iná molekula.
Keď na kvapalné alebo pevné teleso nepôsobia žiadne vonkajšie sily, vzdialenosť medzi ich molekulami je taká, že výsledné sily príťažlivosti a odpudzovania sú nulové. Ak sa pokúsite zmenšiť objem telesa, vzdialenosť medzi molekulami sa zníži a výsledné zvýšené odpudivé sily začnú pôsobiť zo strany stlačeného telesa. Naopak, keď je teleso natiahnuté, vznikajúce elastické sily sú spojené s relatívnym zvýšením príťažlivých síl, pretože Keď sa molekuly od seba vzďaľujú, odpudivé sily padajú oveľa rýchlejšie ako príťažlivé sily.
Molekuly plynu sa nachádzajú vo vzdialenostiach desaťkrát väčších, ako sú ich veľkosti, v dôsledku čoho tieto molekuly navzájom neinteragujú, a preto sa plyny oveľa ľahšie stláčajú ako kvapaliny a pevné látky. Plyny nemajú žiadnu špecifickú štruktúru a sú súborom pohybujúcich sa a zrážajúcich sa molekúl.
Kvapalina je súbor molekúl, ktoré sú takmer blízko seba. Tepelný pohyb umožňuje molekule kvapaliny z času na čas zmeniť svojich susedov a skákať z jedného miesta na druhé. To vysvetľuje tekutosť kvapalín.
Atómy a molekuly pevných látok sú zbavené schopnosti meniť svojich susedov a ich tepelný pohyb je len malými výkyvmi vzhľadom na polohu susedných atómov alebo molekúl. Interakcia medzi atómami môže viesť k tomu, že pevná látka sa stane kryštálom a atómy v nej obsadzujú pozície v miestach kryštálovej mriežky. Keďže molekuly pevných telies sa voči svojim susedom nepohybujú, tieto telesá si zachovávajú svoj tvar.
41. Ideálny plyn v molekulárnej kinetickej teórii.
Ideálny plyn je model riedeného plynu, v ktorom sa zanedbávajú interakcie medzi molekulami. Sily interakcie medzi molekulami sú pomerne zložité. Na veľmi krátke vzdialenosti, keď sa molekuly priblížia k sebe, pôsobia medzi nimi veľké odpudivé sily. Pri veľkých alebo stredných vzdialenostiach medzi molekulami pôsobia relatívne slabé príťažlivé sily. Ak sú vzdialenosti medzi molekulami v priemere veľké, čo sa pozoruje v pomerne riedkom plyne, potom sa interakcia prejavuje vo forme relatívne zriedkavých vzájomných zrážok molekúl, keď letia blízko. V ideálnom plyne je interakcia molekúl úplne zanedbaná.
42. Tlak plynu v molekulárnej kinetickej teórii.
Ideálny plyn je model riedeného plynu, v ktorom sa zanedbávajú interakcie medzi molekulami.
Tlak ideálneho plynu je úmerný súčinu koncentrácie molekúl a ich priemernej kinetickej energie.
Plyn nás obklopuje zo všetkých strán. Kdekoľvek na zemi, aj pod vodou, nesieme časť atmosféry, ktorej spodné vrstvy sa vplyvom gravitácie stláčajú od tých horných. Meraním atmosférického tlaku teda vieme posúdiť, čo sa deje vysoko nad nami a predpovedať počasie.
43. Priemerná hodnota druhej mocniny rýchlosti molekúl ideálneho plynu.
44. Odvodenie základnej rovnice molekulárnej kinetickej teórie plynu. 45. Odvodenie vzorca týkajúceho sa tlaku a priemernej kinetickej energie molekúl plynu.
Tlak p na danej ploche je pomer sily F pôsobiacej kolmo na tento povrch k ploche S jej danej plochy.
Jednotkou tlaku SI je Pascal (Pa). 1 Pa = 1 N/m2.
Nájdite silu F, ktorou molekula s hmotnosťou m0 pôsobí na povrch, od ktorého sa odráža. Pri odraze od povrchu, trvajúcom časový úsek Dt, sa zložka rýchlosti molekuly kolmá na tento povrch, vy, mení na inverznú (-vy). Preto, keď sa odrazí od povrchu, molekula nadobudne hybnosť, 2m0vy, a preto podľa tretieho Newtonovho zákona 2m0vy = FDt, z čoho:
Vzorec (22.2) umožňuje vypočítať silu, ktorou jedna molekula plynu tlačí na stenu nádoby počas intervalu Dt. Na určenie priemernej sily tlaku plynu, napríklad za jednu sekundu, je potrebné zistiť, koľko molekúl sa odrazí za sekundu od plochy povrchu S, a tiež je potrebné poznať priemernú rýchlosť vy molekúl pohybujúcich sa v smere daného povrchu.
Nech je n molekúl na jednotku objemu plynu. Zjednodušme si našu úlohu za predpokladu, že všetky molekuly plynu sa pohybujú rovnakou rýchlosťou, v. V tomto prípade sa 1/3 všetkých molekúl pohybuje pozdĺž osi Ox a rovnaké množstvo pozdĺž osi Oy a Oz (pozri obr. 22c). Nechajte polovicu molekúl pohybujúcich sa pozdĺž osi Oy pohybovať sa smerom k stene C a zvyšok - v opačnom smere. Potom je zrejmé, že počet molekúl na jednotku objemu smerujúcich k stene C bude n/6.
Teraz nájdime počet molekúl, ktoré zasiahnu povrchovú plochu oblasti S (na obr. 22c tieňované) za jednu sekundu. Je zrejmé, že za 1 s budú mať tie molekuly, ktoré sa k nej pohybujú a sú vo vzdialenosti nie väčšej ako v, čas dostať k stene. Preto 1/6 všetkých molekúl nachádzajúcich sa v pravouhlom rovnobežnostene zvýraznenom na obr. zasiahne túto oblasť povrchu. 22c, ktorého dĺžka je v a plocha koncových plôch je S. Keďže objem tohto rovnobežnostena je Sv, celkový počet N molekúl, ktoré zasiahnu časť povrchu steny za 1 s, bude rovný :
Pomocou (22.2) a (22.3) môžeme vypočítať impulz, ktorý za 1 s odovzdal molekulám plynu prierez povrchu steny plochy S. Tento impulz sa bude číselne rovnať tlakovej sile plynu F:
odkiaľ pomocou (22.1) získame nasledujúci výraz týkajúci sa tlaku plynu a priemernej kinetickej energie translačného pohybu jeho molekúl:
kde E CP je priemerná kinetická energia molekúl ideálneho plynu. Vzorec (22.4) sa nazýva základná rovnica molekulárnej kinetickej teórie plynov.
46. Tepelná rovnováha. 47. Teplota. Zmena teploty. 48. Prístroje na meranie teploty.
Tepelná rovnováha medzi telesami je možná len vtedy, keď je ich teplota rovnaká.
Dotknutím sa akéhokoľvek predmetu rukou ľahko zistíme, či je teplý alebo studený. Ak je teplota predmetu nižšia ako teplota ruky, predmet sa javí ako studený a ak je naopak teplý. Ak držíte studenú mincu v päste, teplo ruky začne mincu zahrievať a po určitom čase sa jej teplota vyrovná teplote ruky, alebo, ako sa hovorí, nastane tepelná rovnováha. Teplota teda charakterizuje stav tepelnej rovnováhy systému dvoch alebo viacerých telies s rovnakou teplotou.
Teplota spolu s objemom a tlakom plynu sú makroskopické parametre. Na meranie teploty sa používajú teplomery. Niektoré z nich zaznamenávajú zmeny objemu kvapaliny pri zahrievaní, iné zaznamenávajú zmeny elektrického odporu atď. Najrozšírenejšia je Celziova teplotná stupnica, pomenovaná podľa švédskeho fyzika A. Celsia. Na získanie teplotnej stupnice v stupňoch Celzia pre kvapalinový teplomer sa najskôr ponorí do topiaceho sa ľadu a zaznamená sa poloha konca stĺpca a potom do vriacej vody. Úsek medzi týmito dvoma polohami stĺpca je rozdelený na 100 rovnakých častí za predpokladu, že teplota topiaceho sa ľadu zodpovedá nule stupňov Celzia (o C) a teplota vriacej vody je 100 o C.
49. Priemerná kinetická energia molekúl plynu pri tepelnej rovnováhe.
Základná rovnica molekulárnej kinetickej teórie (22.4) súvisí s tlakom plynu, koncentráciou molekúl a ich priemernou kinetickou energiou. Priemerná kinetická energia molekúl je však spravidla neznáma, hoci výsledky mnohých experimentov naznačujú, že rýchlosť molekúl sa zvyšuje so zvyšujúcou sa teplotou (pozri napr. Brownov pohyb v § 20). Závislosť priemernej kinetickej energie molekúl plynu od jeho teploty možno získať zo zákona, ktorý objavil v roku 1787 francúzsky fyzik J. Charles.
50. Plyny v stave tepelnej rovnováhy (popíšte pokus).
51. Absolútna teplota. 52. Stupnica absolútnej teploty. 53. Teplota je mierou priemernej kinetickej energie molekúl.
Závislosť priemernej kinetickej energie molekúl plynu od jeho teploty možno získať zo zákona, ktorý objavil v roku 1787 francúzsky fyzik J. Charles.
Podľa Charlesovho zákona, ak sa objem daného množstva plynu nemení, jeho tlak pt lineárne závisí od teploty t:
kde t je teplota plynu meraná v o C a p 0 je tlak plynu pri teplote 0 o C (pozri obr. 23b). Z Charlesovho zákona teda vyplýva, že tlak plynu, ktorý má konštantný objem, je úmerný súčtu (t + 273 o C). Na druhej strane z (22.4) vyplýva, že ak je koncentrácia molekúl konštantná, t.j. objem zaberaný plynom sa nemení, potom musí byť tlak plynu úmerný priemernej kinetickej energii molekúl. To znamená, že priemerná kinetická energia, ESR molekúl plynu, je jednoducho úmerná hodnote (t + 273 o C):
kde b je konštantný koeficient, ktorého hodnotu určíme neskôr. Z (23.2) vyplýva, že priemerná kinetická energia molekúl sa bude rovnať nule pri -273 o C. Na základe toho anglický vedec W. Kelvin v roku 1848 navrhol použiť absolútnu teplotnú stupnicu, ktorej nulová teplota by zodpovedala do -273 o C a každý stupeň teploty by sa rovnal stupňu na stupnici Celzia. Absolútna teplota T teda súvisí s teplotou t, meranou v stupňoch Celzia, takto:
Jednotkou SI absolútnej teploty je Kelvin (K).
Berúc do úvahy (23.3), rovnica (23.2) sa transformuje na:
jeho dosadením do (22.4) dostaneme nasledovné:
Aby sme sa zbavili zlomku v (23.5), nahradíme 2b/3 za k a namiesto (23.4) a (23.5) dostaneme dve veľmi dôležité rovnice:
kde k je Boltzmannova konštanta, pomenovaná podľa L. Boltzmanna. Experimenty ukázali, že k = 1,38,10 -23 J/K. Tlak plynu a priemerná kinetická energia jeho molekúl sú teda úmerné jeho absolútnej teplote.
54. Závislosť tlaku plynu od koncentrácie jeho molekúl a teploty.
Vo väčšine prípadov, keď plyn prechádza z jedného stavu do druhého, menia sa všetky jeho parametre - teplota, objem a tlak. Stáva sa to vtedy, keď je plyn stlačený pod piestom vo valci spaľovacieho motora, čím sa zvýši teplota a tlak plynu a zníži sa jeho objem. V niektorých prípadoch sú však zmeny jedného z parametrov plynu relatívne malé alebo dokonca chýbajú. Takéto procesy, kde jeden z troch parametrov – teplota, tlak alebo objem zostáva nezmenený, sa nazývajú izoprocesy a zákony, ktoré ich opisujú, sa nazývajú plynové zákony.
55. Meranie rýchlosti molekúl plynu. 56. Sternov pokus.
Najprv si ujasnime, čo znamená rýchlosť molekúl. Pripomeňme si, že v dôsledku častých zrážok sa rýchlosť každej jednotlivej molekuly neustále mení: molekula sa pohybuje niekedy rýchlo, inokedy pomaly a po určitú dobu (napríklad jednu sekundu) rýchlosť molekuly nadobudne mnoho rôznych hodnôt. . Na druhej strane, v každom okamihu v obrovskom množstve molekúl, ktoré tvoria uvažovaný objem plynu, existujú molekuly s veľmi rozdielnymi rýchlosťami. Samozrejme, aby sme charakterizovali stav plynu, musíme hovoriť o nejakej priemernej rýchlosti. Môžeme predpokladať, že ide o priemernú hodnotu rýchlosti jednej z molekúl za dostatočne dlhé časové obdobie alebo že ide o priemernú hodnotu rýchlostí všetkých molekúl plynu v danom objeme v určitom časovom bode.
Existujú rôzne spôsoby, ako určiť rýchlosť pohybu molekúl. Jednou z najjednoduchších je metóda implementovaná v roku 1920 v Sternovom experimente.
Ryža. 390. Keď je priestor pod sklom A naplnený vodíkom; potom z konca lievika, uzavretého poréznou nádobou B, vychádzajú bubliny
Aby ste to pochopili, zvážte nasledujúcu analógiu. Keď strieľate na pohyblivý cieľ, aby ste ho zasiahli, musíte mieriť do bodu pred cieľom. Ak zamierite na cieľ, guľky zasiahnu za cieľom. Táto odchýlka miesta dopadu od cieľa bude tým väčšia, čím rýchlejšie sa cieľ pohybuje a čím nižšia je rýchlosť striel.
Experiment Otta Sterna (1888–1969) bol venovaný experimentálnemu potvrdeniu a vizualizácii distribúcie rýchlosti molekúl plynu. Toto je ďalší krásny experiment, ktorý umožnil doslova „nakresliť“ graf tohto rozloženia na experimentálnom usporiadaní. Sternova inštalácia pozostávala z dvoch rotujúcich dutých valcov so zhodnými osami (pozri obrázok vpravo; veľký valec nie je úplne nakreslený). Vo vnútornom valci bola priamo pozdĺž jeho osi natiahnutá strieborná niť 1, ktorou prechádzal prúd, ktorý viedol k jeho zahriatiu, čiastočnému roztaveniu a následnému vypareniu atómov striebra z jeho povrchu. Výsledkom bolo, že vnútorný valec, ktorý spočiatku obsahoval vákuum, sa postupne naplnil plynným striebrom nízkej koncentrácie. Vo vnútornom valci, ako je znázornené na obrázku, bola vytvorená tenká štrbina 2, takže väčšina atómov striebra, ktoré dosiahli valec, sa usadila na ňom. Malá časť atómov prešla cez medzeru a spadla do vonkajšieho valca, v ktorom sa udržiavalo vákuum. Tu sa tieto atómy už nezrážali s inými atómami, a preto sa pohybovali v radiálnom smere konštantnou rýchlosťou a dosiahli vonkajší valec po čase nepriamo úmernom tejto rýchlosti:
kde sú polomery vnútorného a vonkajšieho valca a je radiálna zložka rýchlosti častice. V dôsledku toho sa časom na vonkajšom valci 3 objavila vrstva strieborného povlaku. V prípade valcov v pokoji mala táto vrstva tvar pásika umiestneného presne oproti štrbine vo vnútornom valci. Ale ak sa valce otáčali rovnakou uhlovou rýchlosťou, potom v čase, keď molekula dosiahla vonkajší valec, ten sa už posunul o vzdialenosť
v porovnaní s bodom priamo oproti štrbine (t.j. bodom, na ktorom sa častice usadili v prípade stacionárnych valcov).
57. Odvodenie stavovej rovnice ideálneho plynu (Mendelejevova-Clayperonova rovnica)
Plyny sú často reaktanty a produkty chemických reakcií. Nie je vždy možné prinútiť ich, aby za normálnych podmienok navzájom reagovali. Preto sa musíte naučiť, ako určiť počet mólov plynov za iných ako normálnych podmienok.
Na tento účel použite stavovú rovnicu ideálneho plynu (nazývanú aj rovnica Clapeyron-Mendelejev): PV = nRT
kde n je počet mólov plynu;
P - tlak plynu (napríklad v atm;
V – objem plynu (v litroch);
T – teplota plynu (v kelvinoch);
R – plynová konštanta (0,0821 l atm/mol K).
Našiel som odvodenie rovnice, ale je to veľmi komplikované. Stále musíme hľadať.
58. Izotermický proces.
Izotermický dej je zmena skupenstva plynu, pri ktorej zostáva jeho teplota konštantná. Príkladom takéhoto procesu je hustenie pneumatík automobilov vzduchom. Takýto proces však možno považovať za izotermický, ak porovnáme stav vzduchu pred vstupom do čerpadla so stavom v pneumatike po vyrovnaní teploty pneumatiky a okolitého vzduchu. Akékoľvek pomalé procesy prebiehajúce s malým objemom plynu obklopeným veľkým množstvom plynu, kvapaliny alebo pevnej látky s konštantnou teplotou možno považovať za izotermické.
Pri izotermickom procese je súčinom tlaku daného množstva plynu a jeho objemu konštantná hodnota. Tento zákon, nazývaný Boyle-Mariotte, objavili anglický vedec R. Boyle a francúzsky fyzik E. Mariotte a je napísaný takto:
Nájdite príklady!
59. Izobarický proces.
Izobarický proces je zmena skupenstva plynu, ku ktorej dochádza pri konštantnom tlaku.
Pri izobarickom procese je pomer objemu daného množstva plynu k jeho teplote konštantný. Tento záver, ktorý sa na počesť francúzskeho vedca J. Gay-Lussaca nazýva Gay-Lussacov zákon, možno napísať takto:
Jedným príkladom izobarického procesu je expanzia malých bubliniek vzduchu a oxidu uhličitého obsiahnutých v ceste, keď je vložené do pece. Tlak vzduchu vo vnútri a zvonku rúry je rovnaký a teplota vo vnútri je približne o 50 % vyššia ako vonkajšia. Podľa Gay-Lussacovho zákona sa o 50% zväčší aj objem plynových bublín v ceste, vďaka čomu je koláč vzdušný.
60. Izochorický proces.
Proces, pri ktorom sa mení skupenstvo plynu, ale jeho objem zostáva nezmenený, sa nazýva izochorický. Z Mendelejevovej-Clapeyronovej rovnice vyplýva, že pre plyn, ktorý má konštantný objem, musí byť konštantný aj pomer jeho tlaku k teplote:
Nájdite príklady!
61. Odparovanie a kondenzácia.
Para je plyn vytvorený z molekúl, ktoré majú dostatočnú kinetickú energiu na únik z kvapaliny.
Sme zvyknutí, že voda a jej para sa môžu navzájom premieňať. Kaluže na asfalte po daždi vysychajú a vodná para vo vzduchu sa ráno často mení na drobné kvapôčky hmly. Všetky kvapaliny majú schopnosť premeniť sa na paru - prejsť do plynného stavu. Proces premeny kvapaliny na paru sa nazýva vyparovanie. Vznik kvapaliny z jej pár sa nazýva kondenzácia.
Molekulárna kinetická teória vysvetľuje proces odparovania nasledovne. Je známe (pozri § 21), že medzi molekulami kvapaliny pôsobí príťažlivá sila, ktorá im bráni vo vzájomnom pohybe a priemerná kinetická energia molekúl kvapaliny nestačí na prekonanie adhéznych síl medzi nimi. V každom danom okamihu však majú rôzne molekuly kvapaliny rôznu kinetickú energiu a energia niektorých molekúl môže byť niekoľkonásobne vyššia ako jej priemerná hodnota. Tieto vysokoenergetické molekuly majú výrazne vyššiu rýchlosť pohybu a preto dokážu prekonať príťažlivé sily susedných molekúl a vyletieť z kvapaliny, čím sa nad jej povrchom vytvorí para (pozri obr. 26a).
Molekuly, ktoré tvoria paru, ktorá opúšťa kvapalinu, sa pohybujú náhodne, pričom sa navzájom zrážajú rovnakým spôsobom ako molekuly plynu počas tepelného pohybu. Chaotický pohyb niektorých molekúl pár ich zároveň môže odviesť tak ďaleko od povrchu kvapaliny, že sa tam už nikdy nevrátia. Prispieva k tomu samozrejme aj vietor. Naopak, náhodný pohyb iných molekúl ich môže priviesť späť do kvapaliny, čo vysvetľuje proces kondenzácie pár.
Z kvapaliny môžu vyletieť iba molekuly s kinetickou energiou oveľa vyššou ako je priemer, čo znamená, že počas vyparovania sa priemerná energia zostávajúcich molekúl kvapaliny znižuje. A keďže priemerná kinetická energia molekúl kvapaliny, ako je plyn (pozri 23.6), je úmerná teplote, počas vyparovania teplota kvapaliny klesá. Preto vychladneme, len čo opustíme vodu, pokrytú tenkým filmom tekutiny, ktorá sa okamžite začne odparovať a chladiť.
62. Sýta para. Tlak nasýtených pár.
Čo sa stane, ak sa nádoba s určitým objemom kvapaliny uzavrie vekom (obr. 26b)? Každú sekundu budú najrýchlejšie molekuly naďalej opúšťať povrch kvapaliny, jej hmotnosť sa zníži a koncentrácia molekúl pary sa zvýši. Zároveň sa časť jeho molekúl z pary vráti späť do kvapaliny a čím väčšia je koncentrácia pary, tým intenzívnejší bude tento kondenzačný proces. Nakoniec koncentrácia pary nad kvapalinou bude taká vysoká, že počet molekúl vracajúcich sa do kvapaliny za jednotku času sa rovná počtu molekúl, ktoré ju opúšťajú. Tento stav sa nazýva dynamická rovnováha a zodpovedajúca para sa nazýva nasýtená para. Koncentrácia molekúl pary nad kvapalinou nemôže byť väčšia ako ich koncentrácia v nasýtenej pare. Ak je koncentrácia molekúl pary nižšia ako koncentrácia nasýtenej pary, potom sa takáto para nazýva nenasýtená.
Pohybujúce sa molekuly pary vytvárajú tlak, ktorého veľkosť je rovnako ako v prípade plynu úmerná súčinu koncentrácie týchto molekúl a teploty. Preto pri danej teplote platí, že čím vyššia je koncentrácia pary, tým väčší tlak vyvíja. Tlak nasýtených pár závisí od typu kvapaliny a teploty. Čím ťažšie je odtrhnúť molekuly kvapaliny od seba, tým nižší bude tlak nasýtených pár. Tlak nasýtených pár vody pri teplote 20 °C je teda asi 2 kPa a tlak nasýtených pár ortuti pri 20 °C iba 0,2 Pa.
Život ľudí, zvierat a rastlín závisí od koncentrácie vodnej pary (vlhkosti) atmosféry, ktorá sa značne líši v závislosti od miesta a ročného obdobia. Vodná para okolo nás je zvyčajne nenasýtená. Relatívna vlhkosť je pomer tlaku vodnej pary k tlaku nasýtenej pary pri rovnakej teplote, vyjadrený v percentách. Jedným z prístrojov na meranie vlhkosti vzduchu je psychrometer, pozostávajúci z dvoch rovnakých teplomerov, z ktorých jeden je obalený vlhkou handričkou.
63. Závislosť tlaku nasýtených pár od teploty.
Para je plyn tvorený odparenými molekulami kvapaliny, a preto pre ňu platí rovnica (23.7) týkajúca sa tlaku pary p, koncentrácie molekúl v nej n a absolútnej teploty T:
Z (27.1) vyplýva, že tlak nasýtených pár by mal rásť lineárne so zvyšujúcou sa teplotou, ako je to v prípade ideálnych plynov v izochorických procesoch (pozri § 25). Ako však ukázali merania, tlak nasýtených pár rastie s teplotou oveľa rýchlejšie ako tlak ideálneho plynu (pozri obr. 27a). To sa deje v dôsledku skutočnosti, že so zvyšujúcou sa teplotou, a teda aj priemernou kinetickou energiou, ho opúšťa stále viac molekúl kvapaliny, čím sa zvyšuje koncentrácia n pary nad ňou. A preto podľa (27.1) je tlak úmerný n, potom tento nárast koncentrácie pár vysvetľuje rýchlejší nárast tlaku nasýtených pár s teplotou v porovnaní s ideálnym plynom. Nárast tlaku nasýtených pár s teplotou vysvetľuje známy fakt, že pri zahrievaní sa kvapaliny rýchlejšie odparujú. Všimnite si, že akonáhle zvýšenie teploty vedie k úplnému odpareniu kvapaliny, para sa stane nenasýtenou.
Keď sa kvapalina v každej z bublín zahreje, proces vyparovania sa zrýchli a tlak nasýtených pár sa zvýši. Bubliny sa rozpínajú a pod vplyvom Archimedovej vztlakovej sily sa odtrhávajú od dna, plávajú hore a praskajú na hladine. V tomto prípade je para, ktorá naplnila bubliny, odnesená do atmosféry.
Čím nižší je atmosférický tlak, tým nižšia je teplota varu tejto kvapaliny (pozri obr. 27c). Takže na vrchole hory Elbrus, kde je tlak vzduchu polovičný oproti normálnemu, obyčajná voda vrie nie pri 100 o C, ale pri 82 o C. Naopak, ak je potrebné zvýšiť bod varu kvapaliny , potom sa zahrieva pri zvýšenom tlaku. To je napríklad základ pre prevádzku tlakových hrncov, kde je možné jedlo s vodou variť pri teplote vyššej ako 100 o C bez varu.
64. Var.
Var je intenzívny proces vyparovania, ktorý prebieha v celom objeme kvapaliny a na jej povrchu. Kvapalina začne vrieť, keď sa tlak nasýtených pár priblíži tlaku vo vnútri kvapaliny.
Var je tvorba veľkého množstva bublín pary, ktoré plávajú a praskajú na povrchu kvapaliny, keď sa zahrieva. V skutočnosti sú tieto bubliny vždy prítomné v kvapaline, ale ich veľkosť sa zväčšuje a sú viditeľné až pri varení. Jedným z dôvodov, prečo sú v kvapaline vždy mikrobubliny, je nasledujúci. Kvapalina, keď sa naleje do nádoby, vytlačí odtiaľ vzduch, ale nemôže to urobiť úplne a jej malé bubliny zostávajú v mikrotrhlinách a nepravidelnostiach na vnútornom povrchu nádoby. Okrem toho tekutiny zvyčajne obsahujú mikrobubliny pary a vzduchu prilepené na drobné čiastočky prachu.
Keď sa kvapalina v každej z bublín zahreje, proces vyparovania sa zrýchli a tlak nasýtených pár sa zvýši. Bubliny sa rozpínajú a pod vplyvom Archimedovej vztlakovej sily sa odtrhávajú od dna, plávajú hore a praskajú na hladine. V tomto prípade je para, ktorá naplnila bubliny, odnesená do atmosféry. Preto sa var nazýva vyparovanie, ku ktorému dochádza v celom objeme kvapaliny. Var začína pri teplote, keď sú bubliny plynu schopné expandovať, a k tomu dochádza, ak tlak nasýtených pár prekročí atmosférický tlak. Bod varu je teda teplota, pri ktorej sa tlak nasýtených pár danej kvapaliny rovná atmosférickému tlaku. Kým kvapalina vrie, jej teplota zostáva konštantná.
Proces varu je nemožný bez účasti Archimedovskej vztlakovej sily. Preto na vesmírnych staniciach v podmienkach beztiaže nedochádza k varu a ohrev vody vedie len k zväčšeniu veľkosti bublín pary a ich spojeniu do jednej veľkej parnej bubliny vo vnútri nádoby s vodou.
65. Kritická teplota.
Existuje aj koncept ako kritická teplota; ak má plyn teplotu nad kritickou teplotou (individuálna pre každý plyn, napríklad pre oxid uhličitý približne 304 K), potom sa už nemôže zmeniť na kvapalinu, bez ohľadu na to, čo je naň vyvíjaný tlak. Tento jav sa vyskytuje v dôsledku skutočnosti, že pri kritickej teplote povrchové napätie kvapaliny sú nulové.
Tabuľka 23. Kritická teplota a kritický tlak niektorých látok
Čo naznačuje existencia kritickej teploty? Čo sa deje pri ešte vyšších teplotách?
Skúsenosti ukazujú, že pri teplotách vyšších ako kritických môže byť látka iba v plynnom stave.
Na existenciu kritickej teploty prvýkrát poukázal v roku 1860 Dmitrij Ivanovič Mendelejev.
Po objavení kritickej teploty sa ukázalo, prečo sa plyny ako kyslík či vodík dlho nedajú premeniť na kvapalinu. Ich kritická teplota je veľmi nízka (tabuľka 23). Aby sa tieto plyny zmenili na kvapalinu, musia sa ochladiť pod kritickú teplotu. Bez toho sú všetky pokusy o ich skvapalnenie odsúdené na neúspech.
66. Čiastočný tlak. Relatívna vlhkosť. 67. Prístroje na meranie relatívnej vlhkosti vzduchu.
Život ľudí, zvierat a rastlín závisí od koncentrácie vodnej pary (vlhkosti) atmosféry, ktorá sa značne líši v závislosti od miesta a ročného obdobia. Vodná para okolo nás je zvyčajne nenasýtená. Relatívna vlhkosť je pomer tlaku vodnej pary k tlaku nasýtenej pary pri rovnakej teplote, vyjadrený v percentách. Jedným z prístrojov na meranie vlhkosti vzduchu je psychrometer, pozostávajúci z dvoch rovnakých teplomerov, z ktorých jeden je zabalený vo vlhkej handričke.Pri vlhkosti vzduchu nižšej ako 100% sa voda z handričky vyparí a teplomer B bude cool, ukazuje nižšiu teplotu ako A. A čím nižšia je vlhkosť vzduchu, tým väčší je rozdiel Dt medzi údajmi teplomerov A a B. Pomocou špeciálnej psychrometrickej tabuľky možno z tohto teplotného rozdielu určiť vlhkosť vzduchu.
Čiastočný tlak je tlak určitého plynu obsiahnutého v zmesi plynov, ktorý by tento plyn vyvíjal na steny nádoby, ktorá ho obsahuje, ak by sám zaberal celý objem zmesi pri teplote zmesi.
Parciálny tlak sa nemeria priamo, ale odhaduje sa na základe celkového tlaku a zloženia zmesi.
Plyny rozpustené vo vode alebo telesnom tkanive tiež vyvíjajú tlak, pretože molekuly rozpusteného plynu sú v náhodnom pohybe a majú kinetickú energiu. Ak plyn rozpustený v kvapaline narazí na povrch, ako je bunková membrána, vyvíja parciálny tlak rovnakým spôsobom ako plyn v zmesi plynov.
Tlakový tlak nemožno merať priamo, vypočítava sa na základe celkového tlaku a zloženia zmesi.
Faktory, ktoré určujú veľkosť parciálneho tlaku plynu rozpusteného v kvapaline. Parciálny tlak plynu v roztoku je určený nielen jeho koncentráciou, ale aj koeficientom rozpustnosti, t.j. Niektoré typy molekúl, ako napríklad oxid uhličitý, sú fyzikálne alebo chemicky naviazané na molekuly vody, zatiaľ čo iné sú odpudzované. Tento vzťah sa nazýva Henryho zákon a je vyjadrený nasledujúcim vzorcom: Parciálny tlak = koncentrácia rozpusteného plynu / koeficient rozpustnosti.
68. Povrchové napätie.
Najzaujímavejšou vlastnosťou kvapalín je prítomnosť voľného povrchu. Kvapalina, na rozdiel od plynov, nevyplní celý objem nádoby, do ktorej sa naleje. Medzi kvapalinou a plynom (alebo parou) sa vytvára rozhranie, ktoré je v porovnaní so zvyškom kvapaliny v špeciálnych podmienkach. Molekuly v hraničnej vrstve kvapaliny, na rozdiel od molekúl v jej hĺbke, nie sú zo všetkých strán obklopené inými molekulami tej istej kvapaliny. Sily medzimolekulovej interakcie pôsobiace na jednu z molekúl vo vnútri kvapaliny zo susedných molekúl sú v priemere vzájomne kompenzované. Akákoľvek molekula v hraničnej vrstve je priťahovaná molekulami nachádzajúcimi sa vo vnútri kvapaliny (sily pôsobiace na danú molekulu kvapaliny z molekúl plynu (alebo pary) možno zanedbať). V dôsledku toho sa objaví určitá výsledná sila, nasmerovaná hlboko do kvapaliny. Povrchové molekuly sú vťahované do kvapaliny silami medzimolekulovej príťažlivosti. Ale všetky molekuly, vrátane molekúl hraničnej vrstvy, musia byť v rovnovážnom stave. Táto rovnováha sa dosiahne miernym zmenšením vzdialenosti medzi molekulami povrchovej vrstvy a ich najbližšími susedmi vo vnútri kvapaliny. Ako je možné vidieť z obr. 3.1.2, keď sa vzdialenosť medzi molekulami zmenšuje, vznikajú odpudivé sily. Ak sa priemerná vzdialenosť medzi molekulami vo vnútri kvapaliny rovná r0, potom sú molekuly povrchovej vrstvy zbalené o niečo hustejšie, a preto majú dodatočnú zásobu potenciálnej energie v porovnaní s vnútornými molekulami (pozri obr. 3.1.2). . Malo by sa pamätať na to, že vďaka extrémne nízkej stlačiteľnosti nevedie prítomnosť hustejšej povrchovej vrstvy k žiadnej výraznej zmene objemu kvapaliny. Ak sa molekula presunie z povrchu do kvapaliny, sily medzimolekulovej interakcie vykonajú pozitívnu prácu. Naopak, aby bolo možné vytiahnuť určitý počet molekúl z hĺbky kvapaliny na povrch (t.j. zväčšiť povrch kvapaliny), vonkajšie sily musia vykonať pozitívnu prácu ΔAext, úmernú zmene ΔS plocha povrchu: ΔAext = σΔS.
Koeficient σ sa nazýva koeficient povrchového napätia (σ > 0). Koeficient povrchového napätia sa teda rovná práci potrebnej na zväčšenie plochy povrchu kvapaliny pri konštantnej teplote o jednu jednotku.
V SI sa koeficient povrchového napätia meria v jouloch na meter štvorcový (J/m2) alebo v newtonoch na meter (1 N/m = 1 J/m2).
Z mechaniky je známe, že rovnovážne stavy systému zodpovedajú minimálnej hodnote jeho potenciálnej energie. Z toho vyplýva, že voľný povrch kvapaliny má tendenciu zmenšovať svoju plochu. Z tohto dôvodu voľná kvapka kvapaliny nadobúda sférický tvar. Kvapalina sa správa tak, ako keby sily pôsobiace tangenciálne k jej povrchu sťahovali (ťahali) tento povrch. Tieto sily sa nazývajú sily povrchového napätia.
Prítomnosť síl povrchového napätia spôsobuje, že povrch kvapaliny vyzerá ako elastická napnutá fólia, len s tým rozdielom, že elastické sily vo fólii závisia od jej povrchu (t. j. od toho, ako sa fólia deformuje) a od povrchového napätia. sily nezávisia od povrchovej plochy kvapalín.
Niektoré kvapaliny, ako napríklad mydlová voda, majú schopnosť vytvárať tenké filmy. Známe mydlové bubliny majú pravidelný guľovitý tvar – aj to ukazuje pôsobenie síl povrchového napätia. Ak spustíte drôtený rám, ktorého jedna zo strán je pohyblivá, do mydlového roztoku, potom bude celý rám pokrytý filmom kvapaliny.
69. Zmáčanie.
Každý vie, že ak položíte kvapku tekutiny na rovný povrch, roztečie sa po ňom alebo získa okrúhly tvar. Navyše veľkosť a konvexnosť (hodnota tzv. kontaktného uhla) ležiacej kvapky je určená tým, ako dobre zmáča daný povrch. Fenomén zvlhčovania možno vysvetliť nasledovne. Ak sú molekuly kvapaliny navzájom priťahované viac ako molekuly pevnej látky, kvapalina má tendenciu vytvárať kvapôčky.
Ostrý kontaktný uhol sa vyskytuje na zmáčateľnom (lyofilnom) povrchu, zatiaľ čo tupý kontaktný uhol sa vyskytuje na nezmáčateľnom (lyofóbnom) povrchu.
Takto sa správa ortuť na skle, voda na parafíne alebo na „mastnom“ povrchu. Ak sú naopak molekuly kvapaliny k sebe priťahované menej silne ako molekuly pevnej látky, kvapalina je „pritlačená“ k povrchu a šíri sa po ňom. To sa deje kvapkou ortuti na zinkovej platni alebo kvapkou vody na čistom skle. V prvom prípade hovoria, že kvapalina nezmáča povrch (kontaktný uhol je väčší ako 90°) a v druhom prípade ho zmáča (kontaktný uhol je menší ako 90°).
Je to vodoodpudivý lubrikant, ktorý pomáha mnohým zvieratám uniknúť z nadmernej vlhkosti. Napríklad štúdie morských živočíchov a vtákov – kožušinových tuleňov, tuleňov, tučniakov, lykožrútov – ukázali, že ich páperové chlpy a perie majú hydrofóbne vlastnosti, zatiaľ čo ochranné chlpy zvierat a horná časť obrysového peria vtákov sú dobre navlhčené. vodou. Tým sa medzi telom zvieraťa a vodou vytvorí vzduchová vrstva, ktorá zohráva významnú úlohu pri termoregulácii a tepelnej izolácii.
Ale mazanie nie je všetko. Na fenoméne zmáčania hrá významnú úlohu aj povrchová štruktúra. Drsný, hrboľatý alebo pórovitý terén môže zlepšiť zmáčanie. Pripomeňme si napríklad hubky a froté uteráky, ktoré výborne sajú vodu. Ak sa však povrch spočiatku „bojí“ vody, rozvinutý reliéf situáciu len zhorší: kvapôčky vody sa budú zhromažďovať na rímsach a kotúľať sa.
70. Kapilárne javy.
Kapilárne javy sú stúpanie alebo klesanie kvapaliny v trubičkách s malým priemerom - kapilárach. Zmáčavé kvapaliny stúpajú cez kapiláry, nezmáčavé kvapaliny klesajú.
Na obr. Obrázok 3.5.6 znázorňuje kapiláru s určitým polomerom r, spustenú na svojom spodnom konci do zmáčacej kvapaliny s hustotou ρ. Horný koniec kapiláry je otvorený. Stúpanie kvapaliny v kapiláre pokračuje, kým sa gravitačná sila pôsobiaca na stĺpec kvapaliny v kapiláre nerovná veľkosti výsledných síl povrchového napätia Fn pôsobiacich pozdĺž hranice kontaktu kvapaliny s povrchom kapiláry: Fт = Fн, kde Fт = mg = ρhπr2g, Fн = σ2πr cos θ.
To znamená:
Obrázok 3.5.6.
Vzostup zmáčacej tekutiny v kapiláre.
Pri úplnom zvlhčení θ = 0, cos θ = 1. V tomto prípade
Pri úplnom nezmáčaní θ = 180°, cos θ = –1, a teda h< 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
Voda takmer úplne zmáča čistý povrch sklo Naopak, ortuť povrch skla úplne nezmáča. Preto hladina ortuti v sklenenej kapiláre klesne pod hladinu v nádobe.
71. Kryštalické telieska a ich vlastnosti.
Na rozdiel od kvapalín si tuhá látka zachováva nielen svoj objem, ale aj tvar a má výraznú pevnosť.
Rozmanitosť pevných látok, s ktorými sa stretávame, možno rozdeliť do dvoch skupín, ktoré sa výrazne líšia svojimi vlastnosťami: kryštalické a amorfné.
Základné vlastnosti kryštalických telies
1. Kryštalické telesá majú určitú teplotu topenia tmelt, ktorá sa pri procese topenia pri konštantnom tlaku nemení (obr. 1, krivka 1).
2. Kryštalické telesá sú charakterizované prítomnosťou priestorovej kryštálovej mriežky, čo je usporiadané usporiadanie molekúl, atómov alebo iónov, ktoré sa opakuje v celom objeme telesa (riadok s dlhým dosahom). Akákoľvek kryštálová mriežka sa vyznačuje existenciou takého prvku svojej štruktúry, ktorého opakované opakovanie v priestore môže vytvoriť celý kryštál. Toto je jediný kryštál. Polykryštál pozostáva z mnohých veľmi malých monokryštálov spojených dohromady, ktoré sú náhodne orientované v priestore.